Métodos de almacenamiento del hidrógeno
¿Cómo se almacena el hidrógeno?
En el siguiente artículo se analizan las distintas formas de almacenamiento del hidrógeno y su estado de desarrollo en la actualidad. En muchas aplicaciones, el hidrógeno no será producido en el lugar ni en el momento de su consumo. Se puede producir de forma centralizada y ser almacenado para una posterior distribución para su uso final. Por lo tanto, es necesario contar con sistemas de almacenamiento o transporte en toda la cadena de producción y uso del hidrógeno renovable.
El medio de almacenamiento más apropiado dependerá del uso que se le vaya a dar al mismo, del volumen a almacenar, la duración del almacenamiento, la velocidad requerida de descarga, la disponibilidad geográfica de las diferentes opciones y de si se trata de almacenamiento a pequeña o gran escala. En el almacenamiento a gran escala, para aplicaciones estacionarias, el problema de la densidad energética y el tiempo de llenado no son limitantes, mientras que a pequeña escala, para aplicaciones móviles, el problema de la densidad energética y los tiempos de carga son cruciales. Otro factor a tener en cuenta es la pureza del hidrógeno, ya que para su uso en celdas de combustible es de suma importancia una pureza alta, mientras que si se utiliza para quemar, la pureza no será un punto crítico.
El hidrógeno tiene un elevado contenido energético por unidad de masa, 120.1 MJ/Kg. Sin embargo, su baja densidad a temperatura ambiente da como resultado una densidad energética extremadamente baja (0.01 MJ/L). Esto significa que se deben mover mayores volúmenes de hidrógeno para satisfacer demandas de energía idénticas en comparación con otros combustibles. Es necesario un volumen de 11.2 Nm³ (volumen del maletero de un gran vehículo utilitario o comercial) para almacenar solo 1 kg de hidrógeno, que es la cantidad que se requiere para recorrer aproximadamente 100 km. De este modo, para que el almacenamiento de hidrógeno sea económicamente viable, se debe incrementar su densidad de almacenamiento.
Las formas de almacenar hidrógeno se pueden dividir según estén basadas en un almacenamiento físico o en un almacenamiento en materiales (ver Figura 1). En el almacenamiento físico, el hidrógeno se almacena como gas o líquido en forma molecular pura sin ningún enlace físico o químico significativo con otros materiales. Comenzamos analizando estos métodos de almacenamiento, que a día de hoy son los que se emplean en una escala significativa.
La compresión de hidrógeno en estado gaseoso se puede llevar a cabo mediante almacenamiento en tanques o recipientes (dispositivos/vessel), para pequeños volúmenes de almacenamiento, y almacenamiento geológico, para grandes cantidades.
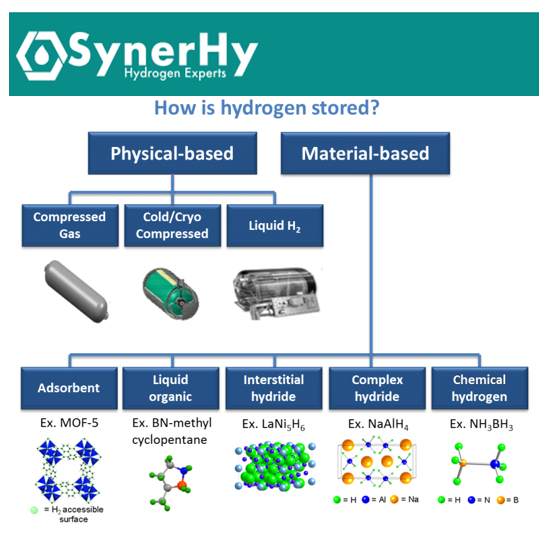
Figura 1. Clasificación de los métodos de almacenamiento de hidrógeno
Para el almacenamiento en tanques hay 4 tipos de cilindros contenedores de alta presión. Los Tipo I son recipientes a presión fabricados en metal. El H₂ que se utiliza como gas industrial se almacena en depósitos de tipo I, cuya presión oscila entre los 150 y los 300 bares. Son los depósitos de alta presión más extendidos en la actualidad y los más baratos, pero su uso es inviable en vehículos por su elevado peso. Los Tipo II son recipientes a presión fabricados con un aro de revestimiento metálico grueso envuelto con un compuesto de fibra de carbono o vidrio. Se utilizan como depósitos de alta presión en hidrogeneras, ya que pueden soportar hasta 1000 bares.
Los tanques Tipo III son recipientes a presión formados por un revestimiento (liner) metálico interno, para evitar las fugas de hidrógeno por difusión, totalmente envuelto por materiales compuestos, que soportan los esfuerzos mecánicos. La eliminación de paredes gruesas metálicas y el mayor uso de materiales compuestos hacen que disminuya su peso en comparación con los tipos I y II. Los Tipo IV, Figura 2, son recipientes a presión fabricados con una camisa polimérica de alta densidad, que actúa como barrera de difusión de gas, totalmente envuelta con un compuesto de fibra de carbono. Estos tanques mantienen las válvulas metálicas para llevar a cabo la recarga y suministro de hidrógeno. Soportan presiones de hasta 700 bar. Los recipientes de tipo III y IV están pensados para aplicaciones portátiles, para las que el ahorro de peso es esencial, y que necesitan presiones entre 350 y 700 bar. Sin embargo, estos recipientes son mucho más caros debido al uso de fibra de carbono.
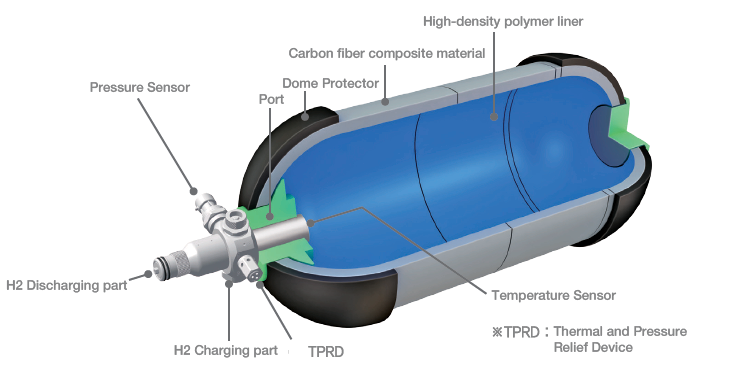
Figura 2. Tanque de alta presión tipo IV

Figura 3. Almacenamiento geológico
Las cavernas de sal, los yacimientos y acuíferos de gas natural o petróleo agotados, que actualmente se utilizan para almacenar gas natural, podrían utilizarse para el hidrógeno. Estas alternativas subterráneas permiten almacenar a gran escala y a largo plazo.
Estados Unidos tiene actualmente en funcionamiento el sistema de almacenamiento de hidrógeno en cavernas de sal más grande; puede almacenar alrededor de 30 días de producción de hidrógeno (entre 10 y 20 mil toneladas).
Los yacimientos de petróleo y gas suelen ser más grandes que las cavernas de sal, pero también son más permeables y contienen contaminantes que deberían eliminarse antes de que el hidrógeno se use en las pilas de combustible. Los acuíferos de agua son las menos maduras de las tres opciones, y aún se está debatiendo su idoneidad.
Además de la compresión, la densidad del hidrógeno puro también se puede aumentar a través de su licuefacción (condensación), convirtiendo el hidrógeno gaseoso en hidrógeno líquido (LH₂). La licuefacción es el proceso de pasar un gas a líquido por medio de modificar sus condiciones de presión y temperatura. Para ello se requieren temperaturas criogénicas, debido a que el punto de ebullición del hidrógeno a una atmósfera de presión es de -252.8 °C. El proceso de licuefacción utiliza una combinación de compresores, intercambiadores de calor y válvulas de expansión para lograr el enfriamiento necesario.
El proceso más simple para la licuefacción es el ciclo de Linde o ciclo de expansión de Joule-Thompson. En este proceso, el gas sufre primero una compresión isotérmica, a temperatura ambiente, después un enfriamiento a presión constante en un intercambiador de calor, y finalmente una expansión isoentálpica. En esta última etapa parte del gas se licua y el resto es re-circulado por el intercambiador de calor, y vuelve al compresor para cerrar el ciclo.
El ciclo de Linde funciona en gases, como el nitrógeno, que se enfrían al expandirse a temperatura ambiente. Sin embargo, el hidrógeno, se calienta al expandirse a temperatura ambiente. Para enfriar el hidrógeno gaseoso en la expansión, su temperatura tiene que ser menor que su temperatura de inversión, -95 °F. Para alcanzar dicha temperatura se realiza un pre-enfriamiento del hidrógeno gaseoso mediante la evaporación de nitrógeno líquido hasta una temperatura inferior a -319 °F antes de la primera expansión de la válvula.
Una vez licuado el hidrógeno, es esencial que pueda almacenarse de forma que se minimice la evaporación. La evaporación del hidrógeno líquido constituye, no solo una pérdida de la energía gastada en licuar el hidrógeno, sino también, a la larga, una pérdida de hidrógeno, ya que el gas evaporado debe ser ventilado debido a la presión que se acumula en el interior del recipiente de almacenamiento. Esta pérdida de hidrógeno almacenado a lo largo del tiempo se conoce como boil-off y se presenta como el porcentaje de hidrógeno almacenado que se pierde por día: la tasa de boil-off. La transferencia de calor del entorno al hidrógeno líquido almacenado y, por tanto, la tasa de boil-off se reducen al minimizar la relación superficie-volumen de los depósitos haciéndolos esféricos, Figura 4.

Figura 4. Tanque de almacenamiento de LH₂ de forma esférica
Los recipientes de LH₂ suelen ser de doble pared con un vacío entre ellas. El vacío minimiza la transferencia de calor por conducción y convección. El espacio entre las paredes del recipiente puede contener materiales adicionales con el objetivo de proteger contra la transferencia de calor por radiación. Como resultado del alto grado de aislamiento y de la baja relación superficie-volumen, las tasas de boil-off son muy bajas en los tanques esféricos más grandes, normalmente por debajo del 0.1 % al día.
Es interesante apuntar que, en la red de más de 100 hidrogeneras (HRS) que existen en Alemania, tanto el transporte del hidrógeno en camiones cisterna como el almacenamiento se realiza en su forma líquida. Se utilizan criocompresores para transformarlo en gas y comprimirlo hasta casi 1000 bares y poder realizar el repostaje en cascada, como veíamos en uno de los artículos anteriores del blog. (Ver video)
El hidrógeno líquido es la tecnología que alcanza mayor densidad energética de almacenamiento (8.4 MJ/L, el doble del alcanzado con los sistemas de compresión a 700 bar). Un inconveniente de este método son los tiempos largos en los procesos de carga y descarga. Es apropiado para almacenar y transportar grandes cantidades de hidrógeno; no obstante, si el periodo de almacenamiento va a ser prolongado en el tiempo son recomendables otras opciones, ya que esta requiere un aporte energético mucho mayor que el necesario para la compresión de hidrógeno gaseoso a alta presión, como se puede ver en la tabla 1.
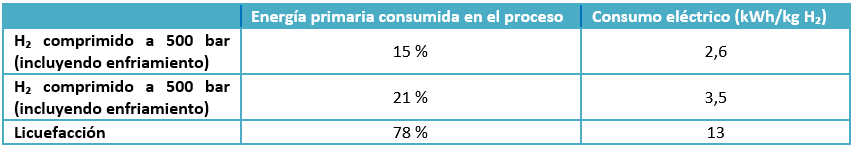
Tabla 1. Comparativa aporte energético entre el CH₂ y el LH₂
El almacenamiento de hidrógeno crio-comprimido (CcH2) es un método híbrido entre el CH₂ y el LH₂. Consiste en almacenar H₂ a temperaturas criogénicas en un recipiente que se puede presurizar (nominalmente a 250–350 bar), en contraste con los recipientes criogénicos actuales que almacenan LH₂. Los tanques crio-comprimidos pueden almacenar hidrógeno líquido, hidrógeno criogénico supercrítico o hidrógeno en una región de dos fases (líquido saturado y vapor). El almacenamiento de hidrógeno líquido en recipientes a presión aislados supera muchas de las deficiencias de los tanques de CH₂ o LH₂ e incluso puede abrir nuevas posibilidades; sin embargo, esta técnica de almacenamiento todavía no está completamente desarrollada hoy en día.
Pasamos en este punto a tratar los métodos de almacenamiento basados en materiales. Estos se pueden clasificar en almacenamiento por adsorción en la superficie de los sólidos, sostenido por enlaces físicos de van der Waals relativamente débiles, o almacenamiento mediante absorción de hidrógeno atómico dentro de los mismos.
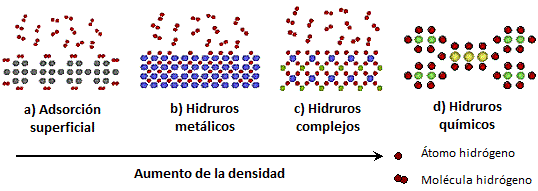
Figura 5. Distintas formas de almacenar hidrógeno en materiales
El hidrógeno puede adsorberse de forma reversible en la superficie de los sólidos porosos, tanto en forma molecular como atómica. El almacenamiento de hidrógeno mediante adsorción aprovecha los enlaces físicos de van der Waals entre el hidrógeno molecular y un material con gran superficie específica. Debido a la debilidad del enlace de van der Waals, normalmente se deben aplicar bajas temperaturas y presiones elevadas para lograr densidades de almacenamiento de hidrógeno significativas mediante adsorción. Uno de los retos más importantes de esta tecnología es la gestión del calor, siendo el nitrógeno líquido el refrigerante más común utilizado en este proceso. La presión aplicada suele ser de 10 a 100 bares, pero varía según el adsorbente y la aplicación prevista. El uso de presiones más altas no es ventajoso más allá de un cierto umbral, ya que la presencia del adsorbente puede dejar de mejorar la capacidad de almacenamiento de hidrógeno en comparación con si el gas presurizado se almacenará en el mismo recipiente, debido al espacio ocupado por el adsorbente.
Se han propuesto muchos adsorbentes para el almacenamiento de hidrógeno, tales como materiales porosos basados en carbono, estructuras metal-orgánicas, zeolitas, etc. En contraste con el almacenamiento de CH₂ o LH₂, hay poca experiencia en la aplicación de esta tecnología y la mayoría de los recipientes desarrollados basados en la adsorción solo se han diseñado a escala de laboratorio.
En cuanto al almacenamiento mediante absorción se puede llevar a cabo mediante portadores de hidrógeno orgánico líquido, hidruros metálicos, hidruros complejos o hidruros químicos.
Los portadores de hidrógeno orgánico líquido (LOHCs) son compuestos orgánicos que pueden absorber y liberar hidrógeno mediante procesos reversibles de hidrogenación y deshidrogenación. La hidrogenación es un tipo de reacción química cuyo resultado final es la adición de hidrógeno a otro compuesto. El hecho de que tanto las formas hidrogenadas como deshidrogenadas de los LOHCs sean líquidas en condiciones ambiente es ventajoso ya que no hay necesidad de producir, capturar o almacenar CO₂ o N₂, y el hidrógeno obtenido tras la deshidrogenación es relativamente puro. Por tanto, los LOHCs permiten el almacenamiento de hidrógeno a presión y temperatura normales.
El proceso, resumido en la Figura 6, consiste en añadir hidrógeno a la sustancia portadora en el punto de origen, mientras se enfría y se presuriza ligeramente, y con ello, se convierte en otra sustancia. Esta nueva sustancia es la que se transporta hasta el punto de destino (en camiones cisterna, barcos…). En el lugar en el que se va a usar, se calienta mientras se le reduce ligeramente la presión. Como resultado se desprende el hidrógeno, convirtiéndose de nuevo en la sustancia inicial, que se puede llevar al lugar de origen para iniciar de nuevo el proceso. Esta tecnología podría beneficiarse de la infraestructura existente, ya que se pueden usar tanques estándar en puertos y áreas industriales.
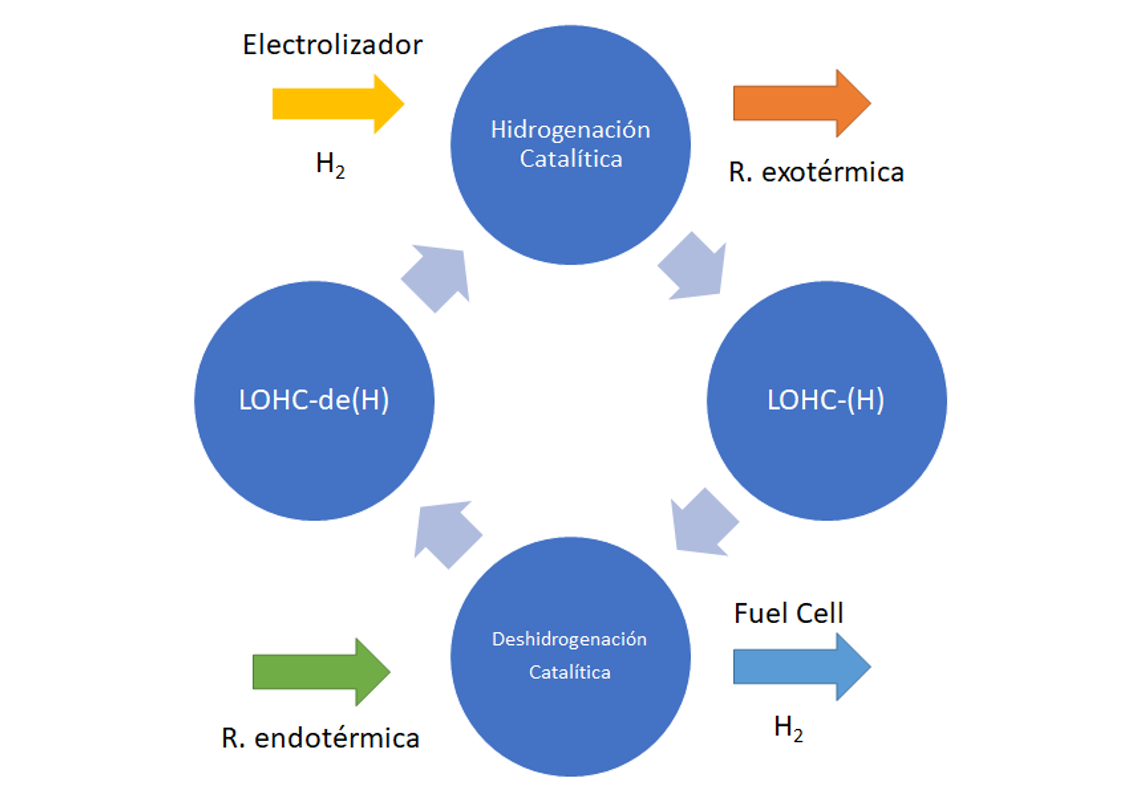
Figura 6. Proceso de almacenamiento de hidrógeno en LOHC
Como ejemplo de LOHC valdría cualquier compuesto insaturado, dado que todos ellos pueden absorber hidrógeno en una fase de hidrogenación. Es ventajoso que ambas formas de los LOHCs tengan un punto de ebullición alto para facilitar la separación del hidrógeno producido durante la deshidrogenación y un punto de congelación bajo para evitar la obstrucción del equipo y mantener la capacidad de bombeo a bajas temperaturas. Aunque hay un número elevado de alternativas teóricamente viables, aún se trabaja en mejorar la viabilidad económica, la seguridad de su manejo y la cantidad de hidrógeno que se transporta en el líquido (que se estima que ha de ser, como mínimo, superior a un 6% en peso).
A pesar de que el metanol y el ácido fórmico son orgánicos y líquidos, no se consideran LOHCs según esta definición, ya que su deshidrogenación solo da lugar a productos gaseosos.
Los hidruros metálicos se forman mediante moléculas de hidrógeno que se disocian en átomos de hidrógeno y se incorporan a la estructura reticular sólida de diversos metales y aleaciones como las de magnesio, titanio, hierro, manganeso, níquel o cromo.
Para formar hidruros metálicos se requiere calor para la absorción de hidrógeno, el cual se distribuye de manera compacta en toda la red de hidruros. La reacción es reversible y viene determinada por la presión del hidrógeno. Si la presión está por encima de la presión de equilibrio, se forma el hidruro metálico; si la presión está por debajo del equilibrio, se libera hidrógeno y la aleación vuelve a su estado original. Esta presión de equilibrio depende de la temperatura, ya que se incrementa con el aumento de ésta y viceversa.
Los átomos de hidrógeno se empaquetan dentro de la estructura metálica y por ello se obtienen mayores densidades de almacenamiento volumétrico respecto al hidrógeno comprimido y líquido. Se puede apreciar este hecho en la tabla 2, dónde se ve la alta densidad volumétrica que tienen hidruros metálicos tales como LaNi₅, FeTi, MgH₂ y LiH.
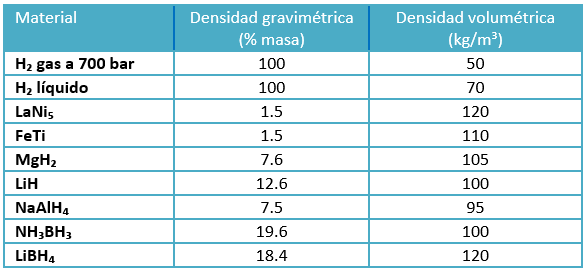
Tabla 2. Densidades de diversos métodos de almacenamiento
La mayoría de los elementos metálicos pueden formar compuestos binarios con hidrógeno, es decir, hidruros elementales. Sin embargo, la mayor parte de estos no son adecuados para el almacenamiento de hidrógeno por diversos motivos. El principal es su baja densidad gravimétrica, tabla 2. Por otro lado, el hidrógeno está unido químicamente en los hidruros metálicos, siendo estos enlaces mucho más fuertes que los enlaces físicos presentes en la adsorción de hidrógeno, lo que implica una mayor energía necesaria para liberar el hidrógeno enlazado químicamente. Además estos hidruros son sensibles a compuestos como el oxígeno y monóxido de carbono, los cuales hacen disminuir la capacidad de absorción de hidrógeno.
En los hidruros complejos metálicos, el hidrógeno está presente como parte de un anión complejo que a su vez está unido a un catión metálico. Los principales grupos de hidruros complejos considerados de interés para el almacenamiento de hidrógeno son los alanatos, los borohidruros y las amidas. Están formados principalmente por elementos bastante ligeros, lo que permite que los hidruros metálicos complejos tengan una capacidad gravimétrica de almacenamiento de hidrógeno bastante alta, un hecho que ha despertado mucho interés en cuanto al uso de estos materiales en aplicaciones de FCV. Se pueden ver las densidades gravimétricas y volumétricas de los hidruros complejos NaAlH₄, NH₃BH₃ y LiBH₄ en la tabla 2.
Desgraciadamente, la mayoría de los hidruros complejos requieren temperaturas bastante elevadas para su deshidrogenación por termólisis, solo unos pocos pueden deshidrogenarse de forma reversible, y generalmente solo en presencia de catalizadores o aditivos adecuados.
Los hidruros químicos son compuestos formados por un elemento no metálico e hidrógeno, unidos mediante enlaces covalentes. Sus elementos son más ligeros que los hidruros metálicos, y a diferencia de estos, suelen ser líquidos en condiciones normales, lo que simplifica su transporte y almacenamiento, así como la transferencia de calor y masa durante los procesos de deshidrogenación e hidrogenación.
Varios de los hidruros químicos sugeridos para el almacenamiento de hidrógeno, como el metanol, el amoníaco y el ácido fórmico, que se sintetizan habitualmente a partir del gas natural, se usan hoy en día como materia prima en la industria química. En otras palabras, la utilidad de estos productos químicos va más allá del almacenamiento de hidrógeno. El hecho de que estos productos químicos ya se produzcan de forma generalizada es ventajoso porque gran parte de la infraestructura necesaria para su producción, almacenamiento y distribución ya existe. Además, la producción de estos productos químicos a granel utilizando hidrógeno procedente de la electrólisis del agua, en lugar del reformado del gas natural, no sólo es útil para almacenar hidrógeno, sino que también es una forma de reducir el uso de combustibles fósiles en la producción de productos químicos a granel.
Conclusiones
Como hemos visto, existen diversas opciones para almacenar hidrógeno a una densidad elevada. Sin embargo, muchas de estas opciones aún se están investigando, ya que son muchos los retos que aún faltan por abordar.
¿Cuál será la forma más eficiente o la preferida para transportar y almacenar el hidrógeno? Necesitamos un tiempo para saberlo y dependerá mucho de su uso final. De lo que estamos seguros es que el hidrógeno renovable será parte fundamental del mix de tecnologías de almacenamiento (hidrógeno, baterías…) que permitirán almacenar los excedentes de energía renovable para su posterior uso.
REFERENCIAS